Aerogel: hoe het is ontstaan
Aerogel: Inleiding en eigenschappen
Aerogel wordt beschouwd als het lichtste vaste materiaal ter wereld. Het bestaat voor 97% uit lucht en voor 3% uit vaste structuur. De dichtheid is slechts 1,5 keer hoger dan die van lucht. Naast zijn extreme lichtheid heeft aerogel ook uitstekende thermische isolatie-eigenschappen, voornamelijk dankzij het “Knudsen-effect”. Omdat aerogel voor het grootste deel bestaat uit silica en lucht, waarbij silica een matige thermische geleidbaarheid heeft en lucht een lage thermische geleidbaarheid.
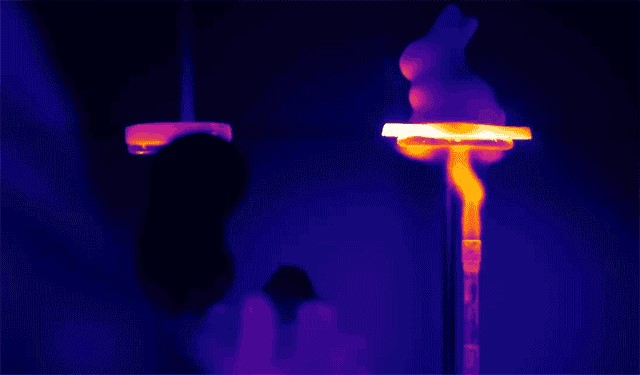

Bovendien bevat aerogel talrijke nanoscopische poriën die de diffusie van lucht door het materiaal belemmeren en convectieve warmteoverdracht belemmeren.

Vanwege de hoge temperatuurbestendigheid wordt aerogel vaak gebruikt voor isolatie in omgevingen zoals Mars-rovers.
Bovendien wordt de waterafstotende eigenschap van aerogel bereikt door modificatie, waarbij polaire -OH-groepen worden omgezet in apolaire -OR-groepen, wat resulteert in een hydrofobe aerogel.

Hoewel het een geavanceerd product van de moderne technologie lijkt, werd aerogel voor het eerst in de jaren dertig ontwikkeld door chemicus Samuel Kistler.
De geboorte van de eerste aerogel
Gelachtige stoffen komen veel voor, zoals de gelatine die wij eten. Deze bestaat uit een combinatie van vaste en vloeibare bestanddelen. Samuel Kistler en zijn collega Charles Learned sloten een weddenschap af over de reden waarom gelatine in een gel verandert. Charles geloofde dat dit kwam door de vloeibare aard van de gel, maar Samuel stelde dat de sleutel lag in de aanwezigheid van een vaste structuur in de gel.
Om zijn gelijk te bewijzen, voerde Samuel experimenten uit om de aanwezigheid van een continu vast netwerk in de natte gel aan te tonen. Het doel was om de vloeistof uit de gel te verwijderen en tegelijkertijd de vaste structuur te behouden. Zo wilden we bewijzen dat de gel en de vloeibare inhoud ervan niets met elkaar te maken hadden. De uitdaging was echter dat het simpelweg verdampen van de vloeistof in de gel ervoor zou zorgen dat de vaste structuur zou krimpen vanwege de aantrekkingskrachten tussen de moleculen, waardoor de gel zou instorten.

Om dit probleem te verhelpen, moest Samuel de vloeistof in de gel vervangen. De enige geschikte optie was gas, omdat de gel al een vaste en een vloeibare toestand bevatte. Normaal gas kon de vloeistof in de gel echter niet vervangen. Samuel koos voor een vernieuwende aanpak: door druk en verhitting op de gel uit te oefenen, zorgde hij ervoor dat de vloeistof het kritische punt overschreed en een superkritische vloeistof werd (zonder onderscheid tussen vloeistof en gas), waardoor de intermoleculaire aantrekkingskrachten werden geëlimineerd.
Samuel koos natriumsilicaat als grondstof, gekatalyseerd door zoutzuur om de hydrolyse te ondersteunen. Water en ethanol dienden als oplosmiddelen bij de uitwisseling en veranderden het in een alcogel. Vervolgens werd de alcogel in een omgeving met hoge temperatuur en hoge druk geplaatst. Toen de ethanol de superkritische vloeibare toestand bereikte, werd de druk in de gel verlaagd. Naarmate de druk afnam, kwamen de ethanolmoleculen vrij als gas. Nadat de ethanol in de gel uit de warmtebron was gehaald en was afgekoeld, verdampte de gel en bleef de vaste structuur gevuld met gas achter: de eerste aerogel.
Dit onderzoek werd in 1931 gepubliceerd in het tijdschrift Nature.
Verbeteringen in de aerogelproductiemethode

Het baanbrekende werk van Samuel was ongetwijfeld verricht, maar het lag meer dan 30 jaar stil vanwege de veeleisende en tijdrovende productieomstandigheden. Pas in 1970, toen de Universiteit van Lyon op zoek was naar een poreus materiaal om zuurstof en raketbrandstof op te slaan, werd het onderzoek naar aerogel hervat en werd Samuels methode verbeterd.
Bij de nieuwe methode werd natriumsilicaat vervangen door tetramethoxysilaan (TMOS) en ethanol door formaldehyde. Deze aanpassing resulteerde in alcogels uit hoogwaardige silica-aerogels en verkortte de bereidingstijd aanzienlijk. Deze verbetering betekende een belangrijke stap voorwaarts in de aerogelwetenschap.
Na deze verbeteringen gingen meer onderzoekers het veld van aerogels betreden.
In 1983 ontdekte de Microstructure Materials Group van Berkeley Lab dat het zeer giftige TMOS vervangen kon worden door het veiligere tetraethoxysilane (TEOS). Ze ontdekten ook dat vóór superkritisch drogen vloeibare CO2 de alcohol in de gel kon vervangen zonder de aerogel te beschadigen.
Dit betekende een aanzienlijke verbetering op het gebied van veiligheid, omdat CO2 niet het explosiegevaar met zich meebrengt dat alcohol wel met zich meebrengt. Tijdens diepgaande studies naar aerogels kwamen natuurkundigen erachter dat dit nanoschaalmateriaal gebruikt kon worden om moeilijk te detecteren Tsjerenkovstralingdeeltjes te verzamelen. Deze deeltjes hebben namelijk moeite om door de complexe structuur van de aerogel te dringen en raken er uiteindelijk in opgesloten.
Naast het verzamelen van deeltjes werden er ook silica-aerogels, geproduceerd door het Jet Propulsion Laboratory van NASA, de ruimte in gelanceerd om komeetstofdeeltjes te verzamelen.

Gezien dit uitgebreide overzicht van de eigenschappen van aerogel en de voortdurend verbeterde productiemethoden, is het duidelijk dat aerogel een uitstekend materiaal is. Ondanks de voordelen wordt het in het dagelijks leven nog niet veel gebruikt.
Ten eerste zijn er uitdagingen in de productie. Hoewel de productiemethoden meerdere malen zijn verbeterd, vormen superkritische omstandigheden nog steeds een groot obstakel.
Ten tweede kent de industriële productie van aerogels een enorme uitdaging: aerogel is erg broos. Hoewel het een hoog draagvermogen heeft, is de treksterkte erg laag, waardoor het gemakkelijk breekt bij lage krachten. Daarom zijn er meestal extra toevoegingen nodig.

